Les utilisations du vanadium et ses utilisations en fonction de ses états d'oxydation
Ce contenu est tiré d'une candidature à la bourse Stanford Advanced Materials College Scholarship de 2025, présentée par Addison Boyle.
Introduction
Levanadium fait partie des métaux de transition ; son numéro atomique est 23. Son abondance dans la croûte terrestre (0,02 %) est similaire à celle du zinc.1 Malgré son abondance, il n'a pas fait l'objet d'une grande attention jusqu'à ces 50 dernières années. Des recherches ont montré que le vanadium pouvait avoir une utilité biologique grâce à l'ion vanadate.2 Il existe au moins 6 états d'oxydation différents ; le vanadium existe principalement en +3, +4 et +5. Lorsqu'il est isolé, chacun des états d'oxydation présente une couleur différente. V4+ est bleu, V3+ est vert et V2+ est violet.3 Ces oxydations sont également les plus pertinentes pour les systèmes biologiques.4
Le vanadium dans le sang :
Ces états d'oxydation du vanadium sont importants car ils peuvent passer par des réactions d'oxydoréduction.4 La stabilité est basée sur la ligature, le solvant et le pH.2 Biologiquement, cela signifie qu'il existe des agents réducteurs qui pourraient convertir le vanadium en états d'oxydation inférieurs.4 Ce processus dépend du pH, lorsque le pH augmente, les potentiels d'oxydoréduction diminuent.4 Lorsqu'il est pris sous forme de médicament, il passe dans la circulation sanguine et entre dans les constituants du sérum sanguin.4 La réaction avec le vanadium détermine la spéciation du vanadium.1
Dans des conditions légèrement acides, le V(III), lorsqu'il est formé, ressemble aux systèmes biologiques existants.1 Le plasma sanguin pourrait contenir des agents réducteurs qui pourraient conduire à la stabilisation du V(III) permettant la formation d'espèces V(III)2-hTF.1 Cesespèces ressemblent au Fe(III) 2-hTF, qui est reconnu par les récepteurs cellulaires.1 Cela peut se faire lorsque le V(III) ou le Fe(III) sont attirés par le hTF si le V(IV)O est disponible dans le plasma sanguin, alors une réduction en V(III) pourrait être favorable en raison du gain d'énergie.1 La liaison du V(III) a un logK 20, tandis que si le V(IV)O+2 a un logK 13.1 Cette réaction doit se faire dans des conditions légèrement acides.1
Il a été observé que d'autres états d'oxydation du vanadium (V(IV) et V(V)) peuvent subir un échange de ligands et une interconversion redox.1 Les ligands de faible masse moléculaire sont le lactate et le citrate, et ceux de masse moléculaire élevée sont le hTF, l'albumine et l'immunoglobuline G.1 Le hTF étant le plus prédominant.1 Comme pour le V(III), le V(IV) et le V(V) réagissent bien en raison des résidus des sites de liaison du Fe(III) au hTF.1 Le Fe(III) 2-hFT est reconnu par les récepteurs cellulaires pour l'endocytose.1 Cela pourrait être possible pour les complexes V(IV) et V(V).1 Lorsque V(IV)OSO4 et l'apo-hTF sont incubés, il est démontré qu'ils correspondent à l'hTF.1 Il est également démontré que le ratio de formation est inférieur à celui du Fe(III) 2hTF.1Il a été constaté que les complexes VIVO et VIVO-porteur, ainsi que le V(V) sous forme de monovanadate, pourraient se lier à l'holo-hTF, qui est l'agent de transport dans le sang.1 Cela signifie que le vanadium pourrait être présent dans le plasma sanguin et passer par l'endocytose lorsque l'holo-hTF pénètre dans les cellules.1
Vanadate :
Il existe trois principaux types de réactions qui peuvent être réalisées avec le vanadate en chimie aqueuse : les réactions d'autocondensation, les réactions de coordination et les réactions d'oxydoréduction.4
Pour les réactions de condensation, les anions vanadate sont protonés par les oligomères dans un environnement légèrement acide pour le rendre plus favorable.4 Ceci est essentiel pour la fonction cellulaire en raison de la façon dont le pH affecte les différents organites.4 Il a été démontré que les cellules tumorales ont un pH élevé.4 Cela pourrait signifier que le vanadate pourrait être utilisé pour trouver les cellules tumorales ayant un pH élevé.4 Cela pourrait être fait avec une série d'oligomères de vanadate dans un environnement acide.4
Le vanadate ayant des similitudes avec le phosphate, il a commencé à être utilisé dans des réactions de coordination, mais il en est encore au stade de l'éprouvette, ce qui signifie que la plupart des réactions de coordination sont théoriques.4 Le phosphate est important pour les systèmes biologiques et intervient dans de nombreux systèmes de reconnaissance biologique et de biocatalyse.1 Les complexes de vanadate ont des géométries trigonales-bipyramidales à 5 coordinats, correspondant aux états transitoires à 5 coordinats supposés se former dans la réaction des enzymes dépendant du phosphate Fig 1.1 Bien qu'il puisse y avoir des ligands mono- et polydentés, ceux qui sont principalement utilisés sont les esters de vanadate et les anhydrides de vanadate, en raison de leur analogie avec le phosphate.4 Avec la modélisation informatique, la plupart du vanadate était sous la forme de H2VO4- et HVO42- en excluant les protéines, lorsque les protéines étaient incluses, la plupart du vanadium était lié à la transferrine.4 Lorsque le complexe métallique du vanadate est stabilisé par des ligands, cela augmente les chances de réduction.4 Cela conduit à des réactions de coordination qui tendent à se réduire dans les systèmes biologiques.4
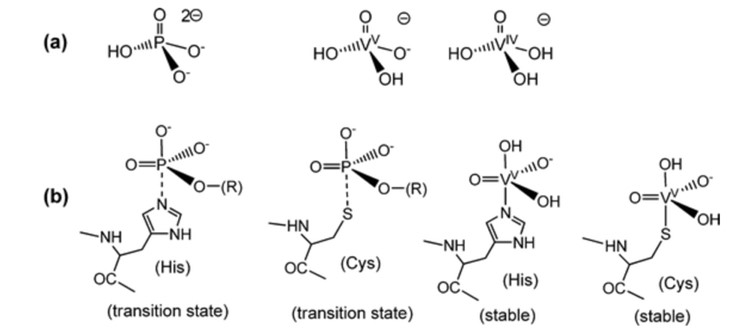
Fig. 1. Comparaison des phosphates et du vanadate avec les états de transition et la stabilité.5
Dans les réactions d'oxydoréduction des systèmes biologiques, les états d'oxydation du vanadium sont +3, +4 et +5.4 La réduction du vanadate se fait principalement en V(IV) à partir de V(V).4 Ce type de réaction se produit dans diverses biomolécules, en particulier dans les organites.4 Il est également utilisé comme tampon pour les protéines phosphotyrosylées.4 Cela conduit à l'intervention dans la voie de signalisation de l'insuline.4 Il peut être utilisé dans le traitement du diabète car une fois lié au site actif de l'enzyme, le vanadate n'est pas facilement libéré comme le phosphate.1 Cela bloque le site du phosphate, conduisant à une inhibition de l'enzyme.1 Il y a des inconvénients à utiliser le vanadate pour traiter le diabète, tels que le stress oxydatif induit par le vanadium, les problèmes de toxicité globale, les effets sur le système immunitaire, et l'inflammation.1
Recherche sur le cancer :
Les propriétés du vanadium ont été étudiées pour leurs effets chimio-préventifs et anti-tumoraux dans la lutte contre le cancer.1 Les tests semblent être principalement effectués sur des animaux et sur des lignées cellulaires malignes.1 Le dichlorure de vanadocène et plusieurs peroxovanadates sont les principaux composés de vanadium qui ont été utilisés.1 Le dichlorure de vanadocène est soluble dans l'eau et, à un pH de 7, les ions chlorure sont remplacés parH2O, ce qui donne V(C5H5)2]2+.1 On a constaté qu'il se lie à l'ADN, ce qui entraîne un comportement différent du cisplatine.1 Il a également montré une toxicité limitée, aucun transfert à travers la barrière sanguine, et n'est pas détecté dans le cerveau.1 Les cibles des propriétés anticancéreuses du vanadium sont la perturbation du métabolisme cellulaire, les voies de transduction des signaux et la perturbation de la prolifération cellulaire.1 Les diverses réponses et la sécurité du vanadium ont suscité des inquiétudes, ce qui a conduit à un manque de recherche clinique.1 En gardant ces inquiétudes à l'esprit, les gens continuent à faire de la recherche.1 Les systèmes V(V)-mhcpe ont été testés in vitro et ont donné des résultats indiquant qu'ils étaient plus toxiques pour les cellules tumorales que pour les cellules non tumorales.1 Les complexes V(IV) qui ont des dérivés de 1-10-phénanthroline comme ligands et les complexes V(IV)O-dppz ont montré des propriétés anticancéreuses Fig 2, en particulier contre la leucémie.1
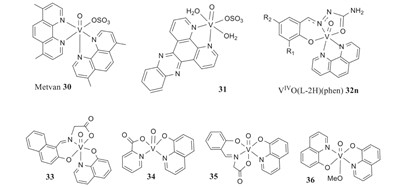
Fig. 2. Représentation des propriétés anti-tumorales des composés de vanadate, avec stabilité du tampon pH 7,1.
Amavadin :
Il existe un champignon qui accumule le vanadium appelé Amanita muscaria, ou l'amanite tue-mouches.6 Un champignon typique contient moins de 0,5 mg de V kg-1, mais A. muscaria peut contenir 100 mg de V kg-1.6 Les parties du corps du champignon qui contiennent du vanadium sont le stipe, la peau du chapeau, la chair du chapeau, les branchies, les spores et le bulbe.6 La plus forte concentration de vanadium se trouve dans le bulbe, avec 1000 mg V kg-1.6 Cette partie du champignon est située dans la partie la plus basse du stipe, ce qui la rend la plus susceptible d'être contaminée par le sol.6 Lorsque l'on examine la couche arable, la médiane du vanadium se situe à 60 mg kg-1, avec une fourchette de 1,28 à 537 mg kg-1.6 Le vanadium trouvé dans A. muscaria était chargé négativement et a été nommé amavadine Fig 3 par Bayer et Kneifel.6 La spectroscopie de résonance paramagnétique électronique (RPE) a permis de découvrir que l'état d'oxydation du vanadium était de +4.6 Les spectres RPE ont également indiqué que les différentes parties du champignon contenaient le même composé, l'amavadine.6 Il s'agit de deux ligands tétradentés (Fig. 3) qui peuvent se coordonner au centre du vanadium, créant ainsi deux isomères qui apparaissent en mélange presque égal dans l'amavadine synthétique et l'amavadine naturelle.6
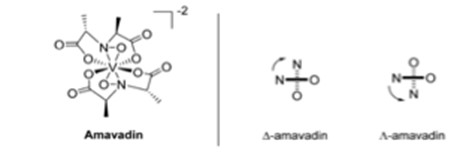
Fig. 3. Structure de l'amavadine, avec les isomères D et L.6
L'oxydation de V(IV) en V(V) est réversible dans l'amavadine, ce qui signifie qu'elle pourrait avoir des propriétés catalytiques.6 On a constaté qu'une large gamme de réactions était catalysée par le complexe.6 Cela a conduit à la synthèse de différents analogues de l'amavadine avec différents centres d'ions métalliques ou des ligands modifiés.6 Lorsque l'amavadine a été synthétisée à partir d'A. muscaria, on a découvert qu'il existait différents complexes de vanadium, le plus important étant l'acétate de vanadyle.6 Le solide contient 26 % (p/p) d'acétate de vanadyle et 74 % (p/p) d'amavadine.6
Conclusion
En conclusion, il a été démontré que le vanadium a de multiples usages dans les systèmes biologiques. Cela va du traitement du cancer aux champignons. La recherche s'est penchée sur les différents états d'oxydation et sur la manière dont ils peuvent être réduits dans les systèmes biologiques, tels que le sang ou les cellules. Les principaux états d'oxydation du vanadium sont +3, +4 et +5. Les ligands généralement associés au vanadium sont des complexes d'oxygène, en particulier le vanadate et l'acétate de vanadyle. Il reste encore des recherches à mener sur le vanadium et les effets qu'il aura sur la communauté scientifique.
Références :
1. J.Costa Pessoa, Journal of Inorganic Biochemistry, 2015, 147, 4-24
2) A. Butler et C. J. Carrano, Coordination Chemistry Reviews, 1991, 109, 61-65
3. D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, New York, 2008.
4. X. Yang et K. Wang, in Progress in Molecular and Subcellular Biology, eds. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic et M. R. Custodio. Springer, Manz, Allemagne, 2013, ch. 1, pp 1-19.
5) D. Rehder, Metallomics, 2015, 7, 732.
6. S. Braeuer, M. Walenta, L. Steiner et W. Goessler, Royal Society of Chemistry, 2021, 36, 954-967.

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


