De meilleurs catalyseurs à base de métaux précieux Pt, Pd et Au : Résoudre les goulets d'étranglement en matière de performances
Résumé
Les catalyseurs à base de métaux précieux sont essentiels pour améliorer l'efficacité des processus énergétiques et chimiques en raison de leur activité intrinsèque exceptionnelle. Cependant, leur déploiement pratique est limité par des défis persistants liés à l'activité, à la sélectivité, à la stabilité et au coût. Cette étude aborde systématiquement les principales limites de performance de trois catalyseurs à base de métaux précieux (Pt, Pd et Au) et examine les stratégies de conception de matériaux avancés conçues pour surmonter ces problèmes. Plus précisément, nous nous concentrons sur
1) L'alliage et les architectures cœur-coquille dans les catalyseurs à base de Pt pour améliorer l'activité de réduction de l'oxygène et la durabilité dans les piles à combustible ;
2) les configurations à atome unique et à nanocluster dans les systèmes à base de Pd pour obtenir une sélectivité supérieure et une résistance au frittage dans les réactions de couplage croisé ; et
3) la conception du support et le contrôle de la taille des catalyseurs à base d'Au pour débloquer une activité élevée dans l'oxydation du CO à basse température.
En comparant les solutions adaptées à ces trois systèmes catalytiques, ce travail vise à fournir des informations interdisciplinaires et à guider la conception rationnelle de la prochaine génération de catalyseurs à base de métaux précieux hautement performants, durables et rentables.

Fig. 1 Catalyseurs à base de nanométaux précieux
1 Introduction
Lescatalyseurs à base de métaux précieux (tels que le platine, le palladium, le rhodium, etc.) sont des matériaux essentiels dans les transitions industrielles et énergétiques modernes, jouant un rôle central dans les secteurs du raffinage, de la synthèse chimique, du contrôle des émissions automobiles et de l'énergie hydrogène. Dans le contexte d'une évolution mondiale vers des structures énergétiques plus propres, le développement rapide des industries des piles à combustible et de l'hydrogène à faible teneur en carbone continue de stimuler la demande de métaux du groupe du platine. Les projections de l'industrie indiquent que d'ici 2030, la capacité mondiale de production d'hydrogène propre devrait dépasser les dix millions de tonnes, ce qui renforce encore l'importance stratégique des catalyseurs à base de métaux précieux dans la chaîne d'approvisionnement énergétique.
Toutefois, l'adoption à grande échelle des catalyseurs à base de métaux précieux se heurte encore à de multiples défis structurels. La production annuelle mondiale de métaux du groupe du platine est limitée et concentrée géographiquement, ce qui rend les chaînes d'approvisionnement très vulnérables aux tensions géopolitiques et à la volatilité du marché. Pour réduire la dépendance à l'égard des ressources extérieures, l'amélioration de l'efficacité du recyclage des matériaux critiques est devenue une stratégie prioritaire pour de nombreux pays. Actuellement, la récupération des métaux précieux à partir des catalyseurs industriels usagés repose principalement sur des processus tels que la pyrolyse, l'extraction hydrométallurgique et la fusion pyrométallurgique. Toutefois, ces méthodes se caractérisent généralement par une consommation d'énergie élevée et des taux de récupération compromis par les impuretés. En matière d'innovation technologique, les chercheurs développent des alternatives aux métaux non précieux et des systèmes de solvants verts afin de réduire la dépendance vis-à-vis des minéraux vierges. Parallèlement, des réglementations environnementales de plus en plus strictes conduisent à la mise en place de systèmes de gestion couvrant l'ensemble du cycle de vie des catalyseurs - de la production à la régénération en passant par l'utilisation - ce qui incite l'industrie à trouver un équilibre entre l'efficacité des ressources et la responsabilité environnementale.
La conception structurelle de précision est apparue comme un paradigme clé pour surmonter les goulets d'étranglement des performances des catalyseurs à base de métaux précieux. Cette stratégie vise à obtenir un contrôle synergique des structures électroniques et géométriques des sites actifs à l'échelle atomique. Plus précisément, les techniques de modulation de la structure électronique, telles que l'alliage et l'ingénierie de la déformation, optimisent le comportement d'adsorption des intermédiaires réactionnels, améliorant ainsi l'activité intrinsèque. L'ingénierie géométrique - telle que la construction d'atomes uniques, de nanoclusters, de plans cristallins spécifiques ou de structures cœur-coquille - maximise la densité et la stabilité des sites actifs. Parallèlement, l'ingénierie de l'interface des porteurs et les effets de confinement spatial permettent de guider avec précision les voies de réaction, surmontant ainsi les difficultés liées au contrôle sélectif et à la stabilité à long terme. Cet article explore systématiquement les stratégies de conception structurelle de trois catalyseurs représentatifs - Pt, Pd et Au - basées sur ce concept.

Fig. 2 Catalyseurs à base de métaux précieux pour la combustion des gaz
2 Problèmes courants et mécanismes de baisse des performances des catalyseurs à base de métaux précieux
2.1 Insuffisance du site actif et faible taux d'utilisation
2.1.1 Adsorption des poisons et blocage des sites actifs
Les impuretés présentes dans l'alimentation de la réaction, telles que les espèces contenant du soufre (par exemple, H₂S, composés organosulfurés) et du chlore (par exemple, ions chlorure, organochlorés), peuvent s'adsorber fortement sur les centres actifs des nanoparticules de métaux nobles. Ce processus de chimisorption conduit souvent à la formation de composés de surface stables tels que le sulfure de rhodium (Rh₂S₃) ou le chlorure de rhodium (RhCl₃), qui occupent et désactivent en permanence les sites catalytiques. De plus, le dépôt de ces impuretés sur le support du catalyseur peut bloquer physiquement les mésopores et les micropores des matériaux carbonés, entravant ainsi la diffusion des molécules réactives vers les sites actifs.
2.1.2 Agglomération de particules métalliques et dégradation du support
Les nanoparticules de métaux nobles (dont la taille est généralement comprise entre 2 et 10 nm) sont susceptibles de migrer et de coalescer pendant les cycles de réaction à haute température, ce qui entraîne la formation de gros agglomérats de plus de 50 nm. Ce phénomène de frittage peut réduire la surface électrochimiquement active de plus de 75 %. Parallèlement, le support en carbone lui-même subit une dégradation lors d'une exposition prolongée à des températures élevées, qui se manifeste par une décomposition thermique, la formation de fissures et une perte de résistance mécanique. Cet effondrement structurel du support accélère encore l'agglomération des particules métalliques et compromet l'intégrité globale de l'architecture du catalyseur.
2.1.3 Dissolution et détachement induits par les fluctuations du processus
Les instabilités opérationnelles, en particulier lorsque le potentiel redox du système de réaction fluctue au-delà de la fenêtre de tolérance du catalyseur (généralement ±0,3 V), peuvent induire une dissolution anodique du métal noble dans les environnements acides. Ce processus génère des espèces ioniques solubles, telles que le Rh³⁺, entraînant une perte irréversible du métal. Parallèlement, une exposition prolongée à des conditions très acides ou alcalines peut provoquer l'hydrolyse ou la neutralisation des groupes fonctionnels à la surface du support en carbone, ce qui affaiblit l'interaction métal-support et entraîne le détachement des particules actives.
2.1.4 Corrosion médiée par la vapeur et effondrement des pores
Dans les systèmes contenant de la vapeur d'eau, la condensation et la perméation de la vapeur dans les nanopores du support en carbone génèrent des forces capillaires et une tension interfaciale. Ces tensions peuvent provoquer des micro-fractures et l'effondrement de la structure des pores. Simultanément, la vapeur d'eau peut interagir avec les impuretés (par exemple, Cl-, SO₄²-) pour former un électrolyte corrosif localisé, qui accélère la dissolution des nanoparticules métalliques et leur détachement ultérieur du support compromis.
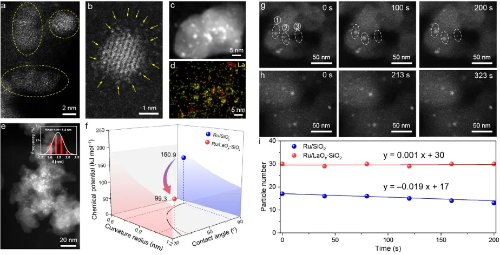
Fig. 3 Catalyseurs insulaires nanostructurés pour contrer le frittage des particules
2.2 Frittage et mûrissement d'Ostwald des nanoparticules
Le frittage des nanoparticules métalliques supportées représente une cause fondamentale de désactivation à haute température des catalyseurs hétérogènes. La compréhension conventionnelle postule que le frittage se produit principalement par le biais de deux mécanismes médiés par le substrat : le mûrissement d'Ostwald et la migration et la coalescence des particules. Alors que des techniques in situ avancées, telles que la microscopie électronique à transmission environnementale, ont validé ces voies dans des conditions de pression quasi ambiante, les mécanismes d'évolution dynamique des nanoparticules dans les conditions industrielles extrêmes de haute température et de haute pression restent mal compris.
Des recherches récentes utilisant des simulations cinétiques réactives de Monte Carlo combinées à des calculs de théorie de la fonctionnelle de la densité ont révélé un mécanisme de saut et de coalescence des particules (PHC) jusqu'alors méconnu dans des conditions de haute pression de CO et de température élevée. Ce processus implique que les nanoparticules d'Au se détachent du support TiO₂(101) anatase, subissent un "saut aérien" par migration en phase gazeuse et coalescent avec d'autres particules. Une fois que les grappes coalescentes dépassent une taille critique, elles se redéposent sur la surface du support. Ce comportement est dû à la forte interaction entre les molécules de CO et les atomes d'Au interfaciaux sous un potentiel chimique de CO élevé, qui dépasse l'énergie de liaison entre les nanoparticules et le support.
Ce mécanisme permet non seulement d'élucider les voies de désactivation rapide des catalyseurs dans des conditions de travail réalistes, mais implique également que le frittage des nanoparticules et la migration inter-supports peuvent se produire de manière beaucoup plus fréquente et dynamique que ce que l'on supposait auparavant. Ces résultats offrent une nouvelle perspective théorique pour comprendre la perte de stabilité thermique des catalyseurs industriels et établissent un cadre méthodologique pour la simulation des systèmes à l'échelle nanométrique sur des échelles spatiales et temporelles couplées.

Fig. 4 Le mûrissement d'Ostwald
2.3 Empoisonnement des catalyseurs à base de métaux précieux
L'empoisonnement des catalyseurs à base de métaux précieux désigne le phénomène par lequel des traces d'impuretés présentes dans le système réactionnel occupent ou dégradent de manière irréversible les sites actifs par chimisorption ou réactions chimiques, entraînant une baisse significative de l'activité et de la sélectivité du catalyseur. Il s'agit de l'une des principales causes de désactivation des catalyseurs industriels.
2.3.1 Mécanismes et types d'empoisonnement
En fonction de la nature de l'interaction entre le poison et les sites actifs, l'empoisonnement est généralement classé en deux catégories :
A) Empoisonnement chimique : Le poison interagit fortement avec les sites actifs par le biais de forces chimiques. Il s'agit de la forme d'empoisonnement la plus courante.
- Empoisonnement par chimisorption forte : Les molécules de poison subissent une chimisorption irréversible ou fortement réversible sur les sites actifs, avec des énergies d'adsorption beaucoup plus élevées que celles des réactifs cibles, bloquant ainsi physiquement les sites. Par exemple, les composés contenant du soufre, du phosphore et du cyanure présentent de très fortes capacités d'adsorption sur de nombreuses surfaces métalliques.
- Empoisonnement par effets électroniques : Le poison modifie la structure électronique (par exemple, le centre de la bande d) des centres actifs des métaux précieux en donnant ou en retirant des électrons, ce qui modifie leur capacité d'adsorption des réactifs et empêche la réaction catalytique.
- Empoisonnement par effets structurels : Certains poisons peuvent induire le réarrangement des atomes de surface, perturbant ainsi la structure géométrique originale des centres actifs.
B) Empoisonnement physique/encrassement : Le poison lui-même peut ne pas interagir fortement chimiquement avec les sites actifs, mais se déposer physiquement sur les sites actifs ou à l'embouchure des pores du support, entravant ainsi le transfert de masse des réactifs.
2.3.2 Poisons courants et leurs mécanismes
Les différents métaux précieux présentent des sensibilités variables à différents poisons. Le tableau ci-dessous énumère les poisons typiques et leurs effets :
Tableau 1 Poisons typiques
|
Catégorie de poison |
Substances représentatives |
Catalyseurs principalement affectés |
Brève description du mécanisme |
|
Composés contenant du soufre |
H₂S, COS, SO₂, mercaptans, thiophène |
Pt, Pd, Rh, Ru |
Les atomes S possèdent une paire d'électrons solitaires, ce qui permet une coordination très efficace avec les orbitales d des métaux précieux, formant des liaisons M-S stables. Ils font partie des poisons les plus courants et les plus puissants. |
|
Composés contenant des halogènes |
Cl-, HCl, organochlorés |
Pt, Pd |
Les ions ou atomes halogènes sont très électronégatifs et s'adsorbent fortement sur les surfaces métalliques, altérant les performances catalytiques par des effets électroniques. Parfois, ils peuvent entraîner une perte de métal en formant des halogénures volatils. |
|
Composés de métaux lourds |
Composés de Pb, Hg, As, Bi, Sn |
La plupart des catalyseurs à base de métaux précieux |
Ces métaux ou leurs ions ont un faible potentiel de dépôt sur les surfaces de métaux précieux et peuvent recouvrir de façon permanente les sites actifs par des réactions irréversibles de déplacement ou d'alliage de métaux. |
|
Composés contenant du phosphore ou de l'azote |
PH₃, phosphines, amines, cyanures |
Ni, Pd, Pt |
Comme pour les composés contenant du S, les atomes P et N ont une forte capacité de coordination et peuvent former des liaisons de coordination stables avec des centres actifs. |
|
Hydrocarbures insaturés / Coke |
Alkènes, alcynes, précurseurs du coke |
La plupart des catalyseurs métalliques |
Subissent des réactions de polymérisation et de déshydrogénation à des températures élevées, formant des dépôts carbonés de poids moléculaire élevé qui recouvrent physiquement les sites actifs et les pores. |
2.3.3 Facteurs influençant le degré d'empoisonnement
Nature du poison : La force d'adsorption, l'encombrement stérique et les effets électroniques de la molécule de poison sur le site actif.
Propriétés du catalyseur : La structure électronique des différents métaux précieux détermine leur résistance à l'empoisonnement ; par exemple, le Pt est sensible au CO, tandis que le Pd est sensible au S. Les propriétés du support influencent également la diffusion et l'adsorption des poisons.
Conditions du processus : Température, pression, concentration des réactifs, etc. Par exemple, une température élevée peut désorber certains poisons mais peut aussi accélérer la cokéfaction ; une atmosphère réductrice peut inhiber l'adsorption de certains poisons oxydants (par exemple, SO₂).
2.4 Dissolution et lixiviation des métaux
La dissolution et la lixiviation des métaux représentent une voie de dégradation critique en électrocatalyse, affectant particulièrement les catalyseurs à base de platine et de palladium dans des conditions opérationnelles. Le mécanisme de dissolution électrochimique implique des processus complexes dépendant du potentiel dans lesquels les atomes de métaux nobles s'oxydent en espèces ioniques solubles. Par exemple, le platine subit une oxydation séquentielle pour former des ions Pt²⁺ et Pt⁴⁺ qui migrent dans l'électrolyte, en suivant une voie dynamique de dissolution et de redéposition où les espèces dissoutes se redéposent de préférence sur des particules plus grandes ou des régions plus cathodiques. Ce phénomène est considérablement accéléré dans des conditions de cycles de potentiel, les taux de dissolution étant fortement influencés par les paramètres opérationnels, notamment les fenêtres de potentiel, la température, le pH et les taux de balayage.
Les défauts structurels sont les principaux sites d'initiation de la dissolution, les coins, les arêtes et les sites de dislocation étant plus sensibles à l'attaque oxydative. Des études in situ avancées révèlent que les nanostructures cœur-coquille, telles que les nanocubes de Pd@Pt, subissent une dégradation exacerbée par des mécanismes de corrosion galvanique et de corrosion induite par les halogénures, qui partent de l'interface cœur-coquille et se propagent vers l'extérieur. Parallèlement, la corrosion du matériau de support, en particulier la dégradation du support en carbone sous des potentiels et des températures élevés, aggrave encore la perte de métal en affaiblissant l'ancrage des particules.
Les stratégies d'atténuation se concentrent sur l'amélioration de la stabilité thermodynamique des atomes métalliques par la modulation de la structure électronique. L'alliage du platine avec des éléments plus nobles tels que l'or se révèle remarquablement efficace, l'incorporation d'Au élevant le potentiel d'amorçage de la dissolution et réduisant les taux de dissolution d'environ 40 % grâce au don d'électrons qui accroît la noblesse du platine. Les architectures cœur-coquille utilisant des matériaux de base moins coûteux (par exemple, le Pd) réduisent simultanément l'utilisation de métaux précieux tout en introduisant une contrainte de compression pour améliorer la stabilité de la coquille. Par ailleurs, la dispersion à l'échelle atomique par le biais de catalyseurs à un seul atome ancrés sur des supports modifiés (par exemple, Pt sur CeO₂ dopé au Zr) permet d'obtenir une stabilité exceptionnelle, maintenant l'intégrité structurelle même dans des conditions hydrothermales difficiles à 800°C en empêchant la migration et le frittage des particules.
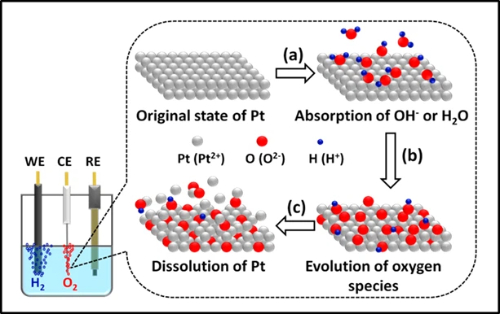
Fig. 5 Phénomène de dissolution du platine dans le processus électrochimique de séparation de l'eau pour la production d'hydrogène
2.5 Perte de contrôle de la sélectivité
Le contrôle précis des voies de réaction représente un défi fondamental dans les réactions complexes à plusieurs étapes, où les catalyseurs à base de palladium présentent souvent une sélectivité compromise en raison d'une énergie d'adsorption intermédiaire non optimisée. Le mécanisme sous-jacent qui régit la sélectivité réside dans la structure électronique des sites actifs, en particulier la position du centre de la bande d, qui détermine les forces d'adsorption des réactifs et des intermédiaires. Dans la réduction électrochimique des nitriles en amines primaires, les catalyseurs conventionnels à base de Pd présentent une force d'adsorption excessive pour les intermédiaires *CH₃CN, favorisant des voies de réduction profonde non souhaitées et des réactions secondaires de dégagement d'hydrogène qui diminuent collectivement l'efficacité faradique pour les produits cibles.
Les stratégies de conception de catalyseurs avancés permettent de remédier à ces limitations grâce à une manipulation précise des structures électroniques et géométriques de la surface. L'ingénierie de la déformation du réseau illustre cette approche, où les aérosols de métallène Pd@Pd-Cu atteignent une sélectivité remarquable de l'éthylamine de 95,38 % en introduisant une déformation compressive contrôlée qui ajuste de manière optimale la position du centre de la bande d et la force d'adsorption intermédiaire. L'incorporation du cuivre génère des surfaces de palladium précisément déformées qui équilibrent l'activation *CH₃CN et la stabilisation intermédiaire *CH₃CH=NH, supprimant efficacement les voies concurrentes.
D'autres innovations émergent des principes de conception à haute entropie, où le métallène à haute entropie PdRhFeCoMo perturbe la symétrie conventionnelle du site par le biais d'un désordre configurationnel. Cet "effet cocktail" crée des environnements de coordination locaux uniques qui améliorent considérablement l'adsorption de l'éthanol et la capacité de rupture des liaisons C-C, ce qui permet d'atteindre une sélectivité sans précédent de la voie C1 de 84,12 % dans l'oxydation de l'éthanol, tout en améliorant simultanément la résistance à l'empoisonnement grâce à un comportement modifié de l'hydrogène en surface.
La synergie bimétallique fournit des dimensions supplémentaires pour l'optimisation de la sélectivité, comme le démontrent les aéros métallènes Pt-Pd où l'incorporation de platine module le centre de la bande d du palladium pour créer des catalyseurs à double fonction capables de promouvoir simultanément l'oxydation anodique de l'éthanol et l'évolution cathodique de l'hydrogène. Cette optimisation de la structure électronique permet d'équilibrer l'énergie d'adsorption pour différents intermédiaires dans plusieurs réactions, ce qui permet des processus en cascade efficaces.
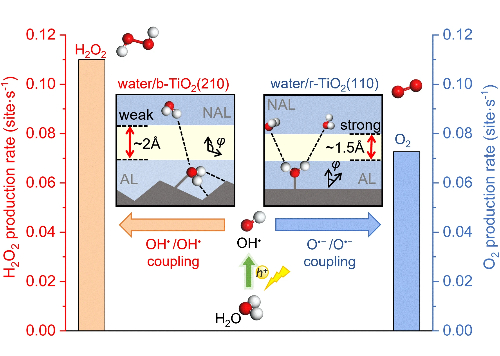
Fig. 6 Contrôle sélectif de l'oxydation photocatalytique de l'eau
3 Trois solutions spécifiques aux matériaux
3.1 Approche des solutions pour les catalyseurs à base de platine
Lescatalyseurs à base de platine (Pt) sont essentiels pour la réaction de réduction de l'oxygène (ORR) à la cathode des piles à combustible à membrane d'échange de protons (PEMFC), mais leur commercialisation à grande échelle reste entravée par trois problèmes fondamentaux : la cinétique lente de l'ORR, le coût élevé dû à la rareté du Pt et la dégradation structurelle - y compris la dissolution, la migration et le frittage des nanoparticules de Pt - dans des conditions de fonctionnement dynamiques telles que les cycles de potentiel et la haute tension. Pour remédier à ces limitations, des stratégies de conception de matériaux avancés ont été développées, principalement axées sur les trois approches suivantes.

Fig. 7 Amélioration de la stabilité des catalyseurs à base de platine pour les piles à combustible
Solution 1 : alliages Pt-M et structures cœur-coquille
Cette approche consiste à adapter la structure électronique du platine par l'introduction de métaux de transition (M), ce qui améliore à la fois l'activité catalytique et la durabilité tout en réduisant la charge de platine.
Description de la stratégie :
Les nanoparticules d'alliage à base de Pt - incorporant des métaux de transition tels que le Ni, le Co, le Fe ou le Cu - sont synthétisées par des méthodes de remplacement par voie humide ou galvanique. On peut également construire des architectures cœur-coquille (par exemple, Pd@Pt) ou des structures Pt-peau, dans lesquelles une coquille riche en Pt renferme un matériau central plus abordable tel que le Pd ou un métal non noble.
Mécanisme d'action :
Effet électronique (ligand) : Le transfert d'électrons des métaux de transition vers le Pt déplace le centre de la bande d du Pt, optimisant l'énergie d'adsorption des intermédiaires contenant de l'oxygène (par exemple, O et OH) et accélérant ainsi la cinétique de l'ORR. Par exemple, la surface Pt3Ni(111) présente une activité ORR dix fois supérieure à celle du Pt(111).
Effet géométrique (déformation) : Le décalage de réseau entre le cœur et l'enveloppe de Pt induit une déformation par compression qui affine encore la structure électronique du Pt et améliore ses performances catalytiques.
Avantage économique :
En concentrant le Pt dans la couche superficielle, les structures cœur-coquille maximisent l'efficacité de l'utilisation du Pt, ce qui réduit considérablement le coût global du catalyseur.
Solution 2 : contrôle de la morphologie et exposition des facettes à indice élevé
Cette stratégie consiste à façonner les nanocristaux de platine pour exposer les facettes cristallines hautement actives, ce qui améliore l'activité massique sans modifier la composition chimique.
Description de la stratégie :
En utilisant des techniques de synthèse colloïdale avec des surfactants et une cinétique de réduction soigneusement contrôlés, des nanostructures de Pt bien définies, telles que des nanocubes (facettes {100}), des octaèdres (facettes {111}) et des structures dendritiques, sont produites.
Mécanisme d'action :
Facettes à haute activité : les facettes à haut indice (par exemple, {730}, {510}) possèdent une forte densité d'atomes en échelon et en coude, qui servent de sites actifs hautement insaturés. Ces sites facilitent le clivage des liaisons O-O et la désorption intermédiaire, ce qui se traduit par une activité ORR intrinsèque supérieure.
Intégrité structurelle : Certaines architectures, telles que les nanoframes et les nanostructures ramifiées, fournissent des cadres robustes qui résistent à la migration et à la coalescence des particules, améliorant ainsi la stabilité catalytique.
Solution 3 : supports stables et forte interaction métal-support
Cette approche vise à atténuer la corrosion du support en carbone - une cause majeure de détachement et de dégradation des nanoparticules de platine - en utilisant des matériaux porteurs robustes et fonctionnalisés.
Description de la stratégie :
Les supports de carbone conventionnels sont remplacés par des matériaux avancés, notamment :
Les carbones graphitiques (par exemple, le graphène, les nanotubes de carbone), connus pour leur conductivité électrique élevée et leur résistance à la corrosion ;
Les carbones dopés aux hétéroatomes (par exemple, N-, B-, P-), qui améliorent l'interaction métal-support et modifient les propriétés électroniques ;
les oxydes/carbures métalliques (par exemple TiO2, SnO2, TiC), qui offrent une excellente stabilité dans des conditions d'oxydation.
Mécanisme d'action :
Interaction forte métal-support (SMSI) : Les groupes fonctionnels ou les défauts à la surface du support forment des liaisons covalentes fortes (par exemple, Pt-O-Ti) avec les nanoparticules de platine, ce qui supprime efficacement la migration des particules, le mûrissement d'Ostwald et le détachement.
Durabilité accrue : La stabilité électrochimique supérieure de ces supports dans des conditions de potentiel élevé minimise la perte de Pt induite par la corrosion, prolongeant ainsi la durée de vie du catalyseur.
Tableau 1 Tableau comparatif des solutions catalytiques à base de platine
|
Solutions |
Stratégies de base |
Mécanismes d'amélioration de l'activité |
Mécanismes d'amélioration de la stabilité |
Rapport coût-efficacité |
Défis majeurs |
|
Alliages Pt-M et structures cœur-coquille |
Régulation de la composition et de la structure |
Les effets du ligand et les effets de la déformation optimisent conjointement les centres de la bande d du Pt, abaissant la barrière énergétique de l'ORR. |
Les éléments d'alliage ou les couches centrales améliorent le potentiel de dissolution du Pt par des effets de support ; certains éléments d'alliage (par exemple, Ni) forment des structures de peau de Pt lors de la dissolution, ce qui améliore la stabilité de la surface. |
Élevé (réduit considérablement la consommation de Pt) |
Les métaux de transition peuvent être lessivés dans les environnements acides, ce qui entraîne une diminution de l'activité et un encrassement de la membrane ; les processus de fabrication des structures cœur-coquille sont complexes. |
|
Contrôle de la morphologie et plans cristallins à indice élevé |
Ingénierie de surface |
L'exposition de plans cristallins à indice élevé avec des atomes de coordination insaturés à haute densité fournit des sites actifs hautement intrinsèques. |
Les structures interconnectées avec des morphologies spécifiques (par exemple, dendrites, nanoframes) suppriment la migration des particules. |
Modéré (utilisation élevée de Pt mais coût de synthèse relativement élevé) |
Les plans cristallins à indice élevé sont généralement instables dans les conditions de réaction et se recomposent facilement en plans à faible énergie ; il est difficile de parvenir à une synthèse évolutive et à la reproductibilité. |
|
Supports stables avec de fortes interactions métal-support |
Ingénierie des supports |
Les supports de carbone dopés peuvent moduler la structure électronique de la platine par des effets électroniques ; ils améliorent le transfert de masse. |
Des interactions fortes ancrent les particules de Pt ; les supports très stables résistent à la corrosion et empêchent le détachement des particules. |
Modérée (le coût du support peut augmenter, mais il prolonge la durée de vie) |
Certains supports très stables (par exemple, les oxydes métalliques) présentent une mauvaise conductivité, ce qui peut accroître la résistance interfaciale ; un contrôle précis des mécanismes d'interaction métal-porteur est nécessaire. |
3.2 Solutions catalytiques à base de palladium
Lescatalyseurs à base de palladium (Pd) sont essentiels dans la synthèse chimique fine, en particulier dans les réactions de couplage croisé et d'hydrogénation/oxydation sélective. Néanmoins, leur mise en œuvre pratique a toujours été entravée par trois défis majeurs : la difficulté de récupérer et de réutiliser les catalyseurs homogènes à base de Pd malgré leur sélectivité élevée ; les sites actifs non uniformes dans les catalyseurs hétérogènes à base de Pd, qui entraînent des problèmes tels que la lixiviation et la désactivation induite par le frittage ; et la difficulté significative d'obtenir un contrôle précis de la sélectivité chimique, régio- et stéréosélectivité. Les stratégies avancées suivantes ont été développées pour traiter simultanément l'activité, la stabilité et la sélectivité.
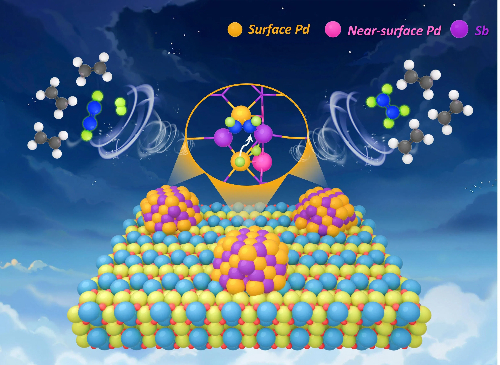
Fig. 8 Site d'hydrogénation du catalyseur au palladium pour les alcènes
Solution 1 : catalyseurs à atome unique
Cette approche consiste à stabiliser le Pd sous forme d'atomes isolés afin de créer des sites actifs structurellement uniformes, offrant ainsi une voie idéale vers une sélectivité et une efficacité atomique maximales.
Description de la stratégie :
Des atomes de Pd isolés sont ancrés sur des supports riches en défauts, tels que des oxydes métalliques (CeO2, TiO2), du nitrure de carbone (g-C3N4) ou du carbone dopé à l'azote (N-C), par des méthodes telles que l'adsorption électrostatique forte, la co-précipitation ou la pyrolyse à haute température.
Mécanisme d'action :
Efficacité atomique maximale et sites actifs uniformes : Chaque atome de Pd sert de site actif indépendant et structurellement identique, ce qui permet d'obtenir une utilisation atomique proche de la théorie. Cette uniformité élimine les réactions secondaires provoquées par des sites actifs hétérogènes, ce qui permet une sélectivité exceptionnellement élevée du produit cible.
Stabilité accrue : De fortes interactions covalentes entre les atomes de Pd et les hétéroatomes (par exemple, O, N) sur la surface du support immobilisent efficacement les espèces de Pd, supprimant la migration, l'agglomération et la lixiviation, améliorant ainsi la durabilité de la catalyse sur plusieurs cycles.
Solution 2 : Nanoclusters et catalyse par confinement
Cette stratégie se concentre sur le contrôle précis du nombre d'atomes de Pd et l'exploitation du confinement spatial pour adapter le comportement catalytique à l'échelle sub-nanométrique, permettant une sélectivité au niveau moléculaire.
Description de la stratégie :
Des clusters de Pd avec une nucléarité bien définie (par exemple, Pd4, Pd8) sont synthétisés à l'aide de méthodes colloïdales ou chimiques précises. Les espèces de Pd sont également encapsulées dans les cadres poreux ordonnés des zéolithes ou des cadres métallo-organiques (MOF) par une synthèse de type "bateau dans une bouteille".
Mécanisme d'action :
Effets de taille quantique : À l'échelle des grappes sub-nanométriques, le Pd présente des structures électroniques discrètes qui diffèrent à la fois des atomes simples et des nanoparticules plus grandes, ce qui entraîne des propriétés catalytiques uniques et l'activation de voies de réaction spécifiques.
Confinement spatial et catalyse sélective de la forme : Les environnements poreux confinés des zéolithes ou des MOF agissent comme des nanoréacteurs qui :
admettent sélectivement les réactifs et libèrent les produits en fonction de la taille et de la forme des molécules (sélectivité de la taille),
restreignent les géométries des états de transition pour contrôler la stéréochimie de la réaction (stéréosélectivité)
isoler physiquement les clusters de Pd pour empêcher l'agrégation et la croissance.
Solution 3 : formation in situ de nanoparticules de Pd en phase liquide
Cette approche tire parti d'un système catalytique dynamique dans lequel des espèces actives de Pd sont générées in situ, combinant les performances élevées de la catalyse homogène avec la récupération facile de la catalyse hétérogène.
Description de la stratégie :
Des précurseurs de Pd solubles (par exemple, Pd(OAc)2) ou des complexes stabilisés par un ligand sont introduits dans le mélange réactionnel, où ils sont réduits in situ dans les conditions de réaction pour former des nanoparticules ou des amas de Pd hautement actifs sur le support ou dans le milieu liquide.
Mécanisme d'action :
Synergie entre catalyse homogène et hétérogène : Les nanoparticules de Pd formées in situ sont petites, défectueuses et très actives, ressemblant ainsi à des catalyseurs homogènes. Après la réaction, ces espèces peuvent être transformées en formes moins actives ou insolubles (par exemple, par oxydation ou agglomération), ce qui permet une séparation et un recyclage simples, semblables à ceux des systèmes hétérogènes.
Atténuation de la désactivation : Ce processus dynamique résout le compromis stabilité-activité : de petites particules très actives se forment pendant la réaction, tandis qu'un état plus stable est adopté après la réaction, ce qui minimise le frittage irréversible et la désactivation pendant la réutilisation.
Tableau 2 Tableau de comparaison horizontale des solutions catalytiques à base de palladium
|
Solution |
Stratégie de base |
Sélectivité Force |
Stabilité Mécanisme |
Utilisation des atomes |
Scénarios applicables |
|
Catalyseurs à atome unique |
Dispersion atomique et homogénéisation structurelle |
Sélectivité chimique et stéréosélectivité |
Forte liaison métal-support |
~100% |
Hydrogénation sélective, oxydation du CO |
|
Nanoclusters et catalyse en milieu confiné |
Nucléarité précise et confinement spatial |
Taille et stéréosélectivité |
Le confinement physique empêche l'agglomération |
Haut niveau |
Synthèse chirale, réactions sélectives de la forme |
|
Formation in situ de nanoparticules de Pd |
Formation dynamique d'espèces actives |
Sélectivité chimique |
L'équilibre dynamique réduit le frittage |
Élevée pendant la réaction, nécessite une réactivation |
Synthèse chimique fine recyclable |
3.3 Solutions catalytiques à base d'or
L'or (Au), bien que chimiquement inerte sous sa forme brute, fait preuve d'une activité catalytique exceptionnelle lorsqu'il est conçu à l'échelle nanométrique et correctement soutenu - une découverte transformatrice qui a remodelé la catalyse moderne. Le déploiement pratique des catalyseurs à base d'or est toutefois confronté à trois défis majeurs : l'inertie intrinsèque de l'or en vrac, la forte tendance des nanoparticules d'or à se fritter ou à subir un mûrissement d'Ostwald dans les conditions de réaction, ce qui entraîne une désactivation rapide, et la sensibilité à l'humidité et à certaines espèces d'empoisonnement. Pour surmonter ces limitations et libérer tout le potentiel des nanocatalyseurs à base d'or, plusieurs stratégies de conception avancées ont été développées, comme indiqué ci-dessous.
Fig. 9 Catalyseurs à base d'or pour la bioconversion
Solution 1 : contrôle de la taille et ingénierie de soutien
Cette approche tire parti des effets quantiques et des interactions avec le support pour activer les nanoparticules d'or en contrôlant précisément leur taille et leur état de dispersion.
Description de la stratégie :
Les nanoparticules d'or d'une taille inférieure à 5 nm - de préférence entre 2 et 3 nm - sont synthétisées par des méthodes telles que le dépôt-précipitation ou la synthèse colloïdale, et déposées sur des supports d'oxydes métalliques réductibles tels que TiO2, Fe2O3 et CeO2.
Mécanisme d'action :
Effets de taille quantique : Lorsque la taille des particules d'Au est inférieure à ∼5 nm, leur structure électronique passe d'une structure métallique à une structure non métallique, ce qui se traduit par une forte proportion d'atomes de surface sous-coordonnés (par exemple, des marches, des arêtes). Ces sites présentent des capacités d'adsorption et d'activation accrues pour les petites molécules telles que le CO et l'O2, ce qui constitue l'origine fondamentale de l'activité catalytique de l'or.
Activation médiée par le support : Certains supports d'oxydes métalliques ne se contentent pas de stabiliser les nanoparticules d'or, ils participent aussi directement aux cycles catalytiques. Par exemple, dans l'oxydation du CO via le mécanisme de Mars-van Krevelen, l'oxygène du réseau du support (par exemple, CeO2) réagit avec le CO, tandis que l'O2 en phase gazeuse remplit les vides d'oxygène, créant ainsi un cycle catalytique synergique entre l'Au et le support.
Solution 2 : Interface Au-Support et sites bifonctionnels
Cette stratégie se concentre sur la conception délibérée de sites interfaciaux entre les nanoparticules d'Au et le support, où se produit une catalyse synergique.
Description de la stratégie :
Grâce à un contrôle minutieux des paramètres de synthèse, tels que la sélection des facettes du support, la température de calcination et l'atmosphère, les nanoparticules d'Au sont finement dispersées afin de maximiser la densité et la stabilité des sites interfaciaux Au-support.
Mécanisme d'action :
Catalyse interfaciale bifonctionnelle : Dans des réactions clés telles que l'oxydation du CO à basse température, le site actif est souvent situé sur le périmètre Au-support. Ici, Au facilite l'adsorption et l'activation du CO, tandis que le support adjacent active l'O2 (ou le H2O). Cette division spatiale et fonctionnelle du travail réduit considérablement la barrière d'activation et augmente les taux de réaction grâce à une interaction synergique.
Solution 3 : alliage et modification de la surface
Cette approche améliore à la fois l'activité et la stabilité des catalyseurs Au en introduisant un second métal ou un oxyde modificateur pour adapter les propriétés électroniques et structurelles.
Description de la stratégie :
L'or est allié à d'autres métaux (par exemple, Pd, Pt, Ag) ou sa surface est modifiée par des oxydes métalliques (par exemple, FeOx, TiOx) pour former des nanoparticules d'alliage ou des architectures cœur-coquille et décorées.
Mécanisme d'action :
Modulation électronique : L'introduction d'un deuxième élément modifie la densité électronique des atomes d'Au par l'intermédiaire des effets de ligand, ce qui permet d'affiner la force d'adsorption des intermédiaires et d'étendre le champ de réaction au-delà de ce que l'Au pur peut réaliser.
Stabilisation structurelle : Le composant secondaire agit comme un espaceur physique, empêchant le contact direct et la coalescence des particules d'or pendant le traitement thermique ou la réaction, améliorant ainsi la résistance au frittage et la longévité opérationnelle.
Tableau 3 Tableau de comparaison horizontale des solutions catalytiques à base d'or
|
Solutions |
Stratégie de base |
Site actif |
Mécanisme d'amélioration de la stabilité |
Avantages |
Principaux défis |
|
Effet de taille et sélection des vecteurs |
Contrôle de la taille des particules (<5 nm) à l'aide de porteurs spécifiques |
Atomes de faible coordination à la surface des petites particules d'Au ; sites d'activation participant au transporteur |
Les porteurs fournissent des sites d'ancrage, supprimant la migration des particules |
Activité intrinsèque élevée, diverses options de porteurs et études approfondies des mécanismes |
Instabilité thermodynamique des petites particules, sujettes au frittage ; forte dépendance à l'égard des propriétés des porteurs. |
|
Construction de l'interface Au-Support |
Contrôle précis de l'interface de contact entre Au et le support |
Sites à double fonction à l'interface Au-Support |
De fortes interactions métal-support stabilisent les particules d'or |
Exploitation complète des effets synergiques entre l'or et le support, avec des sites actifs bien définis |
La structure de l'interface peut se reconfigurer au cours des réactions, ce qui exige une grande reproductibilité dans la préparation. |
|
Alliage et modification de la surface |
Introduction d'un second composant pour réguler les structures électroniques et géométriques |
Atomes Au près des surfaces d'alliage ou des couches modifiées |
Le second composant agit comme une barrière physique, empêchant les particules d'Au d'entrer en contact avec les couches frittées. |
Amélioration simultanée de l'activité et de la stabilité thermique avec une forte capacité de réglage |
Peut introduire un coût ou une complexité ; le second composant peut s'isoler ou être lessivé. |
4 Comparaison globale et perspectives
4.1 Comparaison globale
Grâce à une analyse approfondie des trois principaux catalyseurs à base de métaux précieux - le platine (Pt), le palladium (Pd) et l'or (Au) - nous pouvons résumer systématiquement leurs caractéristiques et leurs solutions, en distillant des principes de conception communs et des orientations de développement futures.
Tableau 4 Comparaison globale des trois catalyseurs à base de métaux précieux
|
Matériau |
Application principale |
Problème principal |
Solution de base |
Effet et caractéristiques |
|
Pt |
Électrocatalyse |
Coût, activité, stabilité |
Contrôle de l'alliage, du noyau, de la coquille et de la morphologie |
Amélioration de l'activité intrinsèque, réduction du dosage |
|
Pd |
Synthèse chimique |
Sélectivité, récupération, désactivation |
Atome unique/amas/confinement |
Permettre une synthèse précise et une séparation facile |
|
Au |
Catalyse environnementale |
Intrinsèquement inerte, sujet au frittage |
Contrôle des dimensions/ingénierie des interfaces |
Active les performances, améliore la stabilité thermique |
4.2 Extraction des principes universels de conception
Bien que les trois catalyseurs soient confrontés à des défis distincts, leurs solutions révèlent des principes communs dans la conception des matériaux catalytiques :
L'ingénierie interfaciale est universellement critique : que ce soit aux interfaces Pt-support, Au-support ou Pd-support, ces régions sont essentielles à la construction d'une catalyse synergique, à l'amélioration des interactions métal-support et à l'amélioration de la stabilité. Les interfaces constituent le principal champ de bataille pour surmonter les limites des matériaux individuels.
La modulation de la structure électronique est essentielle pour améliorer l'activité intrinsèque : La modulation des centres de la bande d des sites actifs par l'alliage, le dopage, l'ingénierie de la déformation et d'autres moyens afin d'optimiser les barrières énergétiques d'adsorption/désorption pour les intermédiaires réactionnels représente une stratégie universelle pour surmonter les goulets d'étranglement de l'activité catalytique.
Le contrôle de la structure géométrique est un outil puissant pour stabiliser les catalyseurs et réguler la sélectivité : Le contrôle précis de l'arrangement géométrique des sites actifs - depuis les atomes uniques et les nanoclusters jusqu'aux plans cristallins à indice élevé - peut simultanément améliorer l'activité en augmentant le nombre d'atomes faiblement coordonnés tout en orientant précisément les voies de réaction et la sélectivité grâce à l'encombrement stérique et aux effets de confinement.
4.3 Perspectives d'avenir
La recherche sur les catalyseurs à base de métaux précieux entre dans une nouvelle phase caractérisée par une intégration multidisciplinaire poussée, des approches fondées sur les données et un accent mis sur le développement durable.
L'intégration entre les systèmes de matériaux et la pollinisation croisée des philosophies de conception apparaîtront comme des orientations clés. Par exemple, l'application du concept mature de structure cœur-coquille des catalyseurs à base de platine aux systèmes à base de palladium pourrait réduire davantage la consommation et les coûts des catalyseurs. Par ailleurs, l'utilisation de stratégies sophistiquées d'ingénierie interfaciale à partir de catalyseurs à base d'or pour améliorer la durabilité des électrocatalyseurs à base de platine pourrait donner naissance à de nouveaux systèmes catalytiques très performants grâce à cette fertilisation croisée d'idées.
L'évolution synergique de l'intelligence artificielle et des techniques de caractérisation avancées transformera profondément les paradigmes de R&D. D'une part, l'apprentissage automatique permettra d'améliorer la qualité de l'air et de l'eau : D'une part, l'apprentissage automatique permettra un criblage virtuel à haut débit, identifiant rapidement les solutions optimales à partir de vastes combinaisons de composition, de structure et de supports afin de parvenir à une "personnalisation à la demande" des catalyseurs. D'autre part, les percées dans les techniques de caractérisation in situ/opérationnelles telles que le rayonnement synchrotron et la microscopie électronique à balayage environnementale permettront d'observer en temps réel, à l'échelle atomique, l'évolution structurelle dynamique dans les environnements réactionnels réels. Cette approche unifiée révélera la nature des sites actifs et des mécanismes de désactivation, ce qui permettra de mieux cibler la conception rationnelle.
En fin de compte, toutes ces avancées technologiques doivent servir le grand objectif du développement durable. Cela signifie que les technologies vertes de recyclage des métaux précieux et la mise en place de systèmes économiques circulaires deviendront tout aussi importantes que la conception des performances des catalyseurs eux-mêmes. Simultanément, le développement de catalyseurs alternatifs à très faible teneur en métaux précieux, voire totalement dépourvus de métaux précieux, constituera la voie fondamentale pour faire face aux contraintes en matière de ressources et parvenir à un développement à long terme dans les secteurs de la chimie et de l'énergie.

Fig. 10 Applications des catalyseurs à base de métaux précieux
Partenaire pour les solutions catalytiques avancées
Stanford Advanced Materials (SAM) fournit des catalyseurs et des supports Pt, Pd et Au de haute pureté, adaptés à vos besoins en matière de R&D et d'industrie. Contactez notre équipe technique pour discuter de solutions personnalisées.
Référence
[1] Zandkarimi, B. ; Poths, P. ; Alexandrova, A. N. When Fluxionality Beats Size Selection : Acceleration of Ostwald Ripening of Sub-Nano Clusters. Angew. Chem. Int. Ed. 2021, *60* (11), 5701-5704. DOI : 10.1002/anie.202100107.
[2] Zhang, S. ; Han, Y. ; Zhu, B. ; Gao, Y. Particle Hopping and Coalescence of Supported Au Nanoparticles in Harsh Reactive Environments. J. Am. Chem. Soc. 2025. DOI : 10.1021/jacs.5c03633.
[3] Liu, L. ; Lu, J. ; Wang, L. ; Xiao, F.-S. La zéolithe Beta désaluminée inverse le mûrissement d'Ostwald pour des catalyseurs durables à base de nanoparticules de cuivre. Science 2023, *382* (6673), 771-776. DOI : 10.1126/science.adj1962.
[4] Li, W. ; Ouyang, R. Stability of Nanocatalysts under Reaction Conditions : A Theoretical Study. J. Am. Chem. Soc. 2013, *135* (5), 1760-1771. DOI : 10.1021/ja3087054.
[5] Li, W., & Ouyang, R. (2013). Stabilité des nanocatalyseurs dans les conditions de réaction : A Theoretical Study. Journal of the American Chemical Society, 135(5), 1760-1771. DOI : 10.1021/ja3087054.
[6] Yin, P., Hu, S., Liang, H. et Li, W. (2021). Quantification de la distance critique entre les particules pour atténuer le frittage des catalyseurs. Nature Communications, 12, 4865. DOI: 10.1038/s41467-021-25116-2.

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Écrire pour nous
Écrire pour nous



 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


