Lithium : Propriétés et utilisations de l'élément
Comprendre l'élément lithium
Qu'est-ce que le lithium ?
Le lithium, de numéro atomique 3 et de symbole Li, est le métal le plus léger du tableau périodique et un métal alcalin. Au cours de ses deux siècles d'existence en tant que curiosité de laboratoire, le lithium est devenu un produit industriel commercialisé dans le monde entier. Aujourd'hui, le raffinage et la production de lithium - par électrolyse du sel ou broyage de minéraux tels que le spodumène - sont à la base d'une industrie de plusieurs milliards de dollars dans les domaines du stockage de l'énergie, de l'exploration spatiale et de l'électronique.

Description des propriétés chimiques
Les propriétés chimiques dulithium reflètent ses propriétés physiques et sont tout aussi distinctives :
-Réactivité : Le lithium réagit vigoureusement avec l'eau pour former de l'hydroxyde de lithium (LiOH) et de l'hydrogène gazeux. Par exemple, un petit morceau de lithium immergé dans l'eau peut développer une effervescence visible en quelques secondes.
-Nature alcaline : Étant un autre métal alcalin, le lithium cède facilement son électron externe pour produire l'ion Li⁺, devenant ainsi un acteur important dans les réactions électrochimiques, y compris dans les batteries lithium-ion.
- Inflammabilité : Le lithium s'enflamme avec une flamme rouge caractéristique, ce que les ingénieurs doivent garder à l'esprit lorsqu'ils travaillent et stockent du lithium en vrac.
Tableau de données sur les propriétés physiques
|
Propriété |
Valeur |
|
Nombre atomique |
3 |
|
Poids atomique |
6,94 g/mol |
|
Point de fusion |
180.54 °C |
|
Point d'ébullition |
1590 °C |
|
Densité |
0,534 g/cm³ |
|
Aspect |
Métal blanc argenté |
|
Dureté |
molle |
|
Conductivité électrique |
élevée |
|
Conductivité thermique |
élevée |
Découverte du lithium
Le lithium a été découvert pour la première fois en 1817 dans la pétalite, une île d'Utö, en Suède. L'analyse d'Arfvedson a révélé un nouvel élément non identifié ayant des propriétés différentes de celles du sodium ou du potassium. Le lithium métallique a ensuite été séparé, par électrolyse des sels de lithium, afin que les scientifiques et les ingénieurs puissent analyser plus en détail ses propriétés physiques et chimiques. Au fil du temps, l'étrange combinaison de la légèreté du lithium, de sa grande réactivité et de son potentiel électrochimique l'a placé sur une trajectoire allant du stockage de l'énergie aux graisses industrielles et à la médecine.
Alliages et composés de lithium
- Alliages lithium-aluminium : Extrêmement légers et durs, ils sont utilisés dans les composants d'avions et les pièces de voitures de sport.
- Alliages lithium-cuivre : Ils améliorent la conductivité électrique et sont souvent utilisés dans les connecteurs et les circuits électroniques.
- Phosphate de lithium-fer (LiFePO₄): Courant dans les cathodes des batteries de voitures électriques en raison de sa stabilité et de sa longue durée de vie.
- Hydroxyde de lithium (LiOH) et carbonate (Li₂CO₃) : D'une importance capitale dans les batteries de recharge, les graisses lubrifiantes et les processus chimiques industriels.
- Chlorure de lithium (LiCl) : Utilisé dans les déshydratants, les climatiseurs et la synthèse chimique.
Par exemple, Tesla et d'autres fabricants de véhicules électriques utilisent des batteries au phosphate de fer-lithium (LFP) dans certaines flottes de voitures, où la stabilité thermique et la densité énergétique sont primordiales pour garantir la sécurité et la fonctionnalité.
Applications courantes
Le lithium a plusieurs applications :
1. Batteries : Les batteries lithium-ion et lithium-polymère dominent le marché de l'électronique portable, des véhicules électriques et des systèmes de stockage d'énergie renouvelable en raison de leur haute densité énergétique.
2. Alliages : Le lithium allège les alliages d'aluminium et de cuivre, améliorant ainsi l'efficacité de l'aérospatiale sans en réduire la résistance.
3. Utilisations médicales : Lithium carbonate stabilizes patients with bipolar disorder, showing lithium's impact beyond industry uses.
4. Verre et céramique résistants à la chaleur : Le lithium améliore la résistance aux chocs thermiques et la solidité.
5. Graisses lubrifiantes : Les graisses au lithium ont de bonnes performances à des températures et des pressions élevées, ce qui est essentiel dans les industries manufacturières et automobiles.
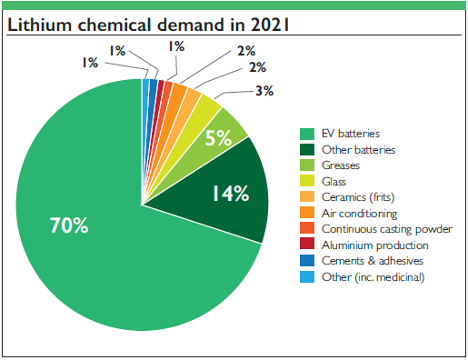 [1]
[1]
Procédés de préparation
Le lithium est principalement obtenu par
1. Le lithium métal est récupéré à partir du LiCl ou du LiF par électrolyse afin d'obtenir une pureté élevée pour les applications commerciales.
2. Extraction de minéraux : Le spodumène et la pétalite sont traités pour former du carbonate ou de l'hydroxyde de lithium qui sera utilisé dans la production de batteries et de produits chimiques.
Questions fréquemment posées
Quelles sont les applications les plus fréquentes du lithium ?
Principalement dans les piles rechargeables, les alliages légers, les graisses lubrifiantes et les produits pharmaceutiques.
Comment extrait-on le lithium ?
Par électrolyse des sels de lithium ou à partir de minerais de spodumène.
Le lithium est-il réactif ?
Oui, en particulier avec l'eau, pour former du LiOH et de l'hydrogène gazeux.
Que sont les batteries lithium-ion ?
Elles alimentent les smartphones, les ordinateurs portables, les véhicules électriques et les systèmes de stockage d'énergie renouvelable en raison de leur densité énergétique élevée et de leur longue durée de vie.
Références :
[1] International Lithium Association (2023, 13 octobre). Lithium 101. Consulté le 17 juillet 2025 sur le site https://lithium.org/lithium-101/

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Écrire pour nous
Écrire pour nous




 Chin Trento
Chin Trento



