Carbone : Propriétés et utilisations des éléments
Description de l'étude
Le carbone est un élément non métallique qui joue un rôle crucial dans les processus vitaux, les applications industrielles et la chimie. Il possède des propriétés chimiques et physiques distinctes qui le rendent très polyvalent.

Présentation de l'élément
Lecarbone, symbolisé par "C" dans le tableau périodique, est un élément chimique de numéro atomique 6. C'est l'un des éléments les plus abondants sur Terre, que l'on retrouve à la fois dans les organismes vivants et dans la croûte terrestre. Sa capacité à former des liaisons stables avec de nombreux éléments, y compris lui-même, le rend essentiel à la vie telle que nous la connaissons.
Le carbone existe à l'état naturel sous diverses formes, notamment le graphite, le diamant et le carbone amorphe (comme le charbon). Il est également un composant essentiel des molécules organiques, qui sont les éléments constitutifs de la vie. Les remarquables capacités de liaison du carbone permettent la création d'une vaste gamme de composés, ce qui en fait un élément central de la chimie organique.
Description des propriétés chimiques
Le carbone présente un large éventail de propriétés chimiques. L'une des principales est sa capacité à former des liaisons covalentes avec divers autres éléments, notamment l'hydrogène, l'oxygène, l'azote et lui-même. Cela le rend très polyvalent dans la formation de différents types de molécules. Voici quelques propriétés chimiques essentielles du carbone :
- Comportement de liaison: Le carbone peut former des liaisons simples, doubles ou triples, selon le type de liaison qu'il partage avec d'autres éléments.
- Réactivité: Bien que le carbone ne soit pas très réactif sous sa forme élémentaire (comme le graphite ou le diamant), il réagit avec l'oxygène à des températures élevées pour former du dioxyde de carbone (CO₂). Il peut également réagir avec les halogènes, l'hydrogène et les métaux.
- États d'oxydation: Le carbone peut présenter des états d'oxydation de -4 (comme dans le méthane, CH₄), 0 (comme dans le graphite ou le diamant), +2 (comme dans le monoxyde de carbone, CO) et +4 (comme dans le dioxyde de carbone, CO₂).
- Allotropes: Le carbone existe sous la forme de plusieurs allotropes, tels que le diamant, le graphite, le graphène et les fullerènes, chacun ayant des propriétés chimiques différentes en raison de la disposition des atomes de carbone.
Tableau de données sur les propriétés physiques
|
Propriété |
Valeur |
|
Nombre atomique |
6 |
|
Densité |
2,267 g/cm³ (diamant), 1,550 g/cm³ (graphite) |
|
Point de fusion |
Sublime à environ 3915°C (diamant) |
|
Point d'ébullition |
Sublime à environ 3915°C (diamant) |
|
Dureté |
Très dure (diamant), molle (graphite) |
|
Conductivité électrique |
Conduit l'électricité (graphite, graphène) |
|
Conductivité thermique |
Bon conducteur (diamant) |
|
Couleur |
Incolore (diamant), gris/noir (graphite) |
Pour plus d'informations, veuillez consulter le site Stanford Advanced Materials (SAM).
Utilisations courantes
Le carbone est utilisé dans une grande variété d'industries en raison de ses diverses propriétés physiques et chimiques :
- Production d'acier: Le carbone est un élément clé de la fabrication de l'acier, où il est utilisé pour modifier les propriétés du fer afin de le rendre plus solide et plus durable.
- Noir de carbone: Utilisé comme pigment noir dans les encres, les peintures et les revêtements.
- Électronique: Le graphite est utilisé dans les composants électroniques tels que les batteries, les condensateurs et comme matériau d'électrode.
- Filtration: Le charbon actif est utilisé dans les systèmes de filtration de l'eau et de l'air pour éliminer les impuretés.
- Lubrifiants: Les propriétés lubrifiantes du graphite lui permettent de réduire les frottements dans les systèmes mécaniques.
- Diamant: Utilisé dans les outils de coupe et les bijoux, le diamant est le matériau connu le plus dur.

Méthodes de préparation
Le carbone peut être obtenu par différentes méthodes, en fonction de la forme souhaitée :
- A partir du charbon: Le carbone est extrait du charbon par un processus appelé "carbonisation", qui consiste à chauffer le charbon à des températures élevées en l'absence d'oxygène pour produire du coke, une forme pure de carbone.
- Legraphite: Le graphite naturel est extrait, et le graphite artificiel peut être fabriqué par le traitement à haute température de matériaux contenant du carbone, comme le coke de pétrole.
- Diamant: Les diamants sont naturels, mais les diamants synthétiques peuvent être fabriqués à l'aide de méthodes à haute pression et à haute température ou par dépôt chimique en phase vapeur (CVD).
- Carbone activé: Produit en chauffant des matériaux riches en carbone, tels que le bois ou les coquilles de noix de coco, en présence de gaz pour créer un matériau poreux avec une surface élevée.
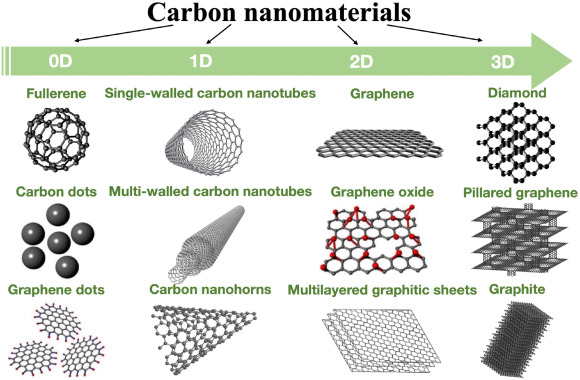 [1]
[1]
Produits industriels connexes
Le carbone est au cœur de nombreux processus et produits industriels :
- Composites de carbone: Utilisés dans les secteurs de l'aérospatiale, de l'automobile et du sport pour fabriquer des matériaux légers et résistants.
- Les nanotubes de carbone: Ils sont utilisés dans l'électronique, les dispositifs de stockage d'énergie et les applications nanotechnologiques en raison de leur résistance et de leur conductivité.
- Dioxyde de carbone (CO₂): Largement utilisé dans la production de boissons gazeuses, d'extincteurs et comme réfrigérant.
Questions fréquemment posées
Quelle est la forme la plus courante du carbone ?
Le carbone se trouve le plus souvent sous forme de graphite, de diamant et de carbone amorphe (comme le charbon).
Le carbone est-il toxique ?
Le carbone lui-même n'est pas toxique sous sa forme élémentaire, mais le monoxyde de carbone (CO), un gaz produit par la combustion incomplète de combustibles contenant du carbone, peut être très toxique.
Pourquoi le carbone est-il important pour la vie ?
Le carbone est l'épine dorsale de toutes les molécules organiques, y compris les protéines, les lipides et les acides nucléiques, ce qui le rend essentiel aux processus vitaux.
Quelles sont les utilisations du charbon actif ?
Le charbon actif est utilisé dans les systèmes de filtration, tels que les purificateurs d'eau et d'air, pour éliminer les impuretés et les toxines.
Quelle est la différence entre le diamant et le graphite ?
Bien que tous deux soient entièrement constitués d'atomes de carbone, le diamant possède une structure cristalline qui en fait le matériau le plus dur de la planète, tandis que le graphite est constitué de couches d'atomes de carbone disposées selon une structure planaire qui lui permet d'être doux et glissant.
Références :
[1] Kuan Cheng, Samuel Wallaert, Haleh Ardebili, Alamgir Karim, Advanced triboelectric nanogenerators based on low-dimension carbon materials : A review,
Carbon, Volume 194, 2022, Pages 81-103, ISSN 0008-6223, https://www.sciencedirect.com/science/article/pii/S0008622322002093

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Écrire pour nous
Écrire pour nous




 Chin Trento
Chin Trento



